Parte I: Guía didáctica del profesor
I.2. Propuesta de enseñanza: selección y análisis de contenidos
La propuesta de enseñanza que presentamos forma parte del Bloque 3 de contenidos de Física y Química de 3º de ESO que figura en el Decreto 291/2007, de 14 de Septiembre, que establece el currículo de la Educación Secundaria Obligatoria en la Comunidad Autónoma de la Región de Murcia. Se trata de los contenidos relacionados con la “Diversidad y unidad de estructura de la materia”, concretamente, los epígrafes siguientes:
- La materia y sus estados de agregación: sólido, líquido y gaseoso
- Teoría cinética y cambios de estado
Dichos contenidos están presentes en los currículos de Física y Química de la educación básica, con independencia del marco legal, pues introducen al alumno en el conocimiento químico de la materia. Aunque la teoría cinética molecular obvia la composición atómica de las partículas, no deja de ser un contenido deseable para introducir a los alumnos en el mundo de la química pues permite diferenciar y establecer relaciones entre los niveles macro, micro y simbólico de la materia. El nivel macro al abordar las propiedades comunes a cada estado de agregación (tener o no forma y volumen propio) y las semejanzas y diferencias en su comportamiento por efecto de la presión y temperatura (difusión, compresión, dilatación); el nivel micro al postular la naturaleza discontinua de la materia para explicar dicho comportamiento, ofreciendo un modelo que reconoce la existencia de partículas (modelo cinético corpuscular o particular, según autores) y describe, a través de presupuestos teóricos (partículas que son extremadamente pequeñas, que ocupan posiciones fijas en sólidos, que están muy juntas en los sólidos, que sólo vibran en los sólidos, etc.) su comportamiento dinámico en función de su agregación; y el nivel simbólico al tener necesariamente que visualizar el modelo, para comprender las explicaciones que se dan al comportamiento macroscópico desde en nivel microscópico.
Sin embargo, las relaciones entre el nivel macro y micro de la materia no suelen abordarse en la mayoría de las propuestas de enseñanza de modo suficiente y explicito, y menos aún las relaciones con el nivel simbólico; así, las diferencias que se establecen en las propiedades comunes al estado de agregación, y las semejanzas y diferencias en el comportamiento macroscópico de sólidos, líquidos y gases, no se interpretan de modo explicito desde los postulados del modelo cinético particular y las diferentes estructuras que resultan a nivel microscópico, posiblemente, porque los profesores conocen las dificultades de aprendizaje que tiene para los alumnos, pues les exige una capacidad de abstracción que no dispone la mayoría. La propuesta de enseñanza que presentamos, utilizando analogías, tiene como finalidad facilitar estas relaciones, haciendo más comprensivo el aprendizaje de estos contenidos. Las analogías favorecen que los alumnos, que están en la transición entre pensamiento concreto y abstracto, puedan visualizar el modelo cinético particular, comprender mejor sus presupuestos y establecer relaciones con las propiedades y comportamiento de sólidos, líquidos y gases.
La propuesta de enseñanza comienza con el estudio de los estados de agregación, por tanto, obvia algunos conceptos iniciales en el estudio de la materia que resultan conveniente hayan sido abordados previamente; por tanto, serían prerrequisitos para mejorar el aprendizaje sobre los contenidos propios de la propuesta. A continuación, se señalan cuáles son los contenidos que los alumnos han debido estudiar previamente con las recomendaciones didácticas correspondientes:
- Concepto de materia. La primera aproximación al concepto de materia debería hacerse a través de su identificación en palabras concretas (Plastilina. Presión. Madera. Cristal. Agua. Dolor. Cobre. Alcohol. Aire. Butano. Calor. Colonia. Papel. Plástico. Granito. Color. Temperatura. …..). Todas tienen un significado construido por otras personas, que compartimos o podemos compartir, pero sólo algunas son materia. La mayor parte de las cosas que identificamos como materia son fácilmente percibidas por nuestros sentidos. Se trata, primero, de reconocer que no todos los objetos o fenómenos que conocemos son materia; y segundo, definirla de modo operativo a través de sus propiedades generales en el nivel macroscópico.
- Concepto de sistema material. El estudio de la materia, de sus propiedades y cambios como resultado de diferentes interacciones, requiere delimitar una porción de la misma al que llamamos sistema material. Se trata de abordar el estudio de la materia (concepto abstracto) a partir de sistema materiales concretos (sistema 1: un cubito de hielo; sistema 2: cubito de hielo + vaso cristal; sistema 3: cubito de hielo + vaso de cristal + aire de habitación;….), más o menos complejos, que se delimitan en función de los problemas que se quieren plantear.
- Concepto de propiedad general de la materia. Tras la identificación de la materia por su diferencia sensorial con lo que no es materia, debe identificarse operativamente asignándoles propiedades generales a cualquier sistema material que se vaya a estudiar; en el nivel macroscópico son suficientes la masa, el volumen y la temperatura. Aunque no sea habitual referirse a la temperatura al introducir el concepto de materia, es conveniente hacerlo antes del estudio de la agregación de la materia; se recomienda trabajar con la balanza y la probeta para medir masas y volúmenes de sólidos, de líquidos y, si es posible, de gases, así como hacer medidas de temperatura de líquidos con el termómetro. Es importante que los alumnos comprendan que los gases tienen masa, volumen y temperatura, por tanto, que también son materia pues, a esas edades, algunos alumnos le asignan un carácter inmaterial. Se deben trabajar los conceptos de magnitud y unidad de medida, primero, con medidas directas de magnitudes (masa, volumen y temperatura) y, segundo, con medidas indirectas (cálculo de volumen de sólido regular a partir de medida de longitudes; cálculo del volumen de sólido irregular por medida con probeta del líquido desplazado). También debería comprobarse la conservación de masa y volumen en cambios de forma de sólidos y líquidos.
- Concepto de diversidad de la materia. Frente al reconocimiento de la unidad de la materia a nivel macroscópico, a través de sus propiedades generales, es necesario reconocer su diversidad como consecuencia de tres hechos: la agregación (sólidos, líquidos y gases), la composición (mezclas y sustancias puras) y las fases (homogénea y heterogénea). Dichos hechos constituyen criterios de clasificación que permiten identificar a los sistemas materiales asignándoles las correspondientes categorías; un puñado de arena es una mezcla sólida heterogénea; el agua de una botella mineral es una mezcla líquida homogénea; etc. Es importante que los alumnos entiendan que son criterios diferentes para identificar los sistemas materiales y, también, que para comprender mejor la diversidad de la materia debemos conocer el significado de cada criterio y categoría.
- Concepto de propiedad específica de la materia. Es conveniente diferenciar otras propiedades conocidas por los alumnos (color, olor, densidad, solubilidad, elasticidad, etc.) de las propiedades generales, destacando la variabilidad de las propiedades específicas en función de la composición de la materia. También, la importancia de las mismas para identificar en el nivel macroscópico si el sistema material es una mezcla o una sustancia pura, o si el fenómeno que se estudia conlleva un cambio químico o físico en la materia. Se trataría de que los alumnos identifiquen la presencia o ausencia de una sustancia pura ante cambios cotidianos como los cambios de forma, cambios de estado, mezclas,…, mediante el reconocimiento de sus propiedades específicas antes y después del cambio.
Una vez explicitado el referente curricular y los prerrequisitos de aprendizaje, corresponde delimitar y justificar el contenido de enseñanza relacionado con los estados de agregación y los cambios de estado. Dicho contenido es el que se muestra a continuación:
| CONTENIDOS |
|---|
|
1. Estados de agregación: sólidos, líquidos y gases
1.1. Propiedades comunes al estado de agregación 1.2. Dependencia de la agregación de la materia con presión y temperatura 1.3. Diferencia entre prototipos y no-prototipos |
|
2. Comportamiento macroscópico de los gases
2.1. Fenómeno de difusión 2.2 Fenómenos de comprensión y expansión 2.3 Fenómenos de dilatación y contracción |
|
3. Comportamiento macroscópico de sólidos y líquidos
3.1. Semejanzas y diferencias entre sólidos, líquidos y gases (fenómenos de difusión, compresión y dilatación) 3.2. Relación entre el comportamiento macroscópico y las propiedades comunes a cada estado |
|
4. Cambios de estado de la materia: descripción macroscópica
4.1. Identificación de los diferentes cambios: fusión, solidificación, vaporización, condensación, sublimación y sublimación regresiva 4.2. Reversibilidad de los cambios de estado y permanencia de las sustancias 4.3. Temperaturas de cambio de estado: propiedad específica de las sustancias puras |
|
5. Interpretación microscópica de la materia: Modelo Cinético-Particular
5.1. Presupuestos del Modelo Cinético-Particular 5.2. Interpretación microscópica de sólidos, líquidos y gases |
|
6. Uso de analogías para analizar el nivel microscópico de los estados de agregación y cambios de estado de la materia
6.1. Análisis de semejanzas y diferencias entre el nivel microscópico y el análogo 6.1.1. Analogía del estado sólido: batallón militar 6.1.2. Analogía del estado líquido: pista de baile 6.1.3. Analogía del estado gaseoso: partido de fútbol 6.1.4. Analogía de cambios de estado: clase de educación física |
|
7. Relación entre el nivel macro, micro y simbólico de la materia
7.1. Niveles de estudio de la materia 7.2. Análisis de nuevos fenómenos: el embudo que no cuela, la gota de aceite que flota y el líquido que sube por el tubo 7.2.1. Descripción, en términos de propiedades, de los estados de agregación 7.2.2. Interpretación desde el Modelo Cinético-Particular 7.2.3. Representación simbólica |
|
7.3. Gráficas de cambio de estado 7.3.1. Identificación de puntos de fusión / congelación y ebullición / condensación 7.3.2. Relaciones calor, temperatura y energía interna en los diferentes tramos de la gráfica 7.3.3. Relaciones entre el movimiento, fuerzas de cohesión y separación de las partículas |
Como puede apreciarse, el contenido de enseñanza incluye diferentes analogías (batallón militar, pista de baile, partido de futbol y clase de educación física) que, valga la redundancia, son consideradas contenidos de enseñanza. Conviene recordar que la selección de estas analogías no es arbitraria, sino el resultado de un análisis previsto en el modelo ACA. Dado que la capacidad de razonamiento analógico está determinada por las posibles relaciones que puedan establecerse entre análogo y tópico, se ha realizado un análisis del contenido de las analogías previo al diseño de la propuesta de enseñanza para decidir sobre su adecuación, introducir modificaciones y derivar implicaciones para la enseñanza. Siguiendo el modelo estructural (Figura 3), el análisis ha requerido:
a) identificar los sistemas que se comparan: análogo y tópico;
b) diferenciar los elementos que intervienen en la comparación: componentes, atributos y nexos;
c) establecer la trama analógica o relaciones entre análogo y tópico.
En el análisis, para completar el posible razonamiento analógico, se ha tenido en cuenta que las relaciones entre análogo y tópico deben contemplar tanto las semejanzas como diferencias, por ello, el análisis también incluye las limitaciones de la analogía.
El análisis, cuyo resultado se presenta más adelante, se ha realizado sobre los siguientes sistemas:
1. El Modelo Cinético – Particular de la materia.
2. El batallón militar para el estado sólido.
3. La celebración de una fiesta para el estado líquido.
4. El partido de fútbol para el estado gaseoso.
5. La clase de educación física para el cambio de estado.
En cada caso, el análisis ha supuesto la discusión y consenso del significado atribuido a los elementos que constituyen la estructura de la analogía, su aplicación a los sistemas señalados y la triangulación de resultados entre los investigadores.
En relación con los resultados del análisis realizado, nos interesa destacar los siguientes hechos:
• Se han concretado y formulado los presupuestos del modelo cinético particular que se utiliza en la propuesta de enseñanza (Cuadro 1a), así como el análisis estructural del tópico científico (Cuadro 1b).
• Se han redefinido los sistemas análogos que se habían seleccionado para el estado sólido, líquido y gas, aunque sin modificar la imagen pictórica, y completado el análisis estructural de cada análogo (Cuadros 2a, 3a y 4a).
• Se han definido las relaciones analógicas entre los diferentes análogos seleccionados y el modelo cinético particular (Cuadros 2b, 3b, 4b).
• Se ha generado un nuevo análogo, clase de educación física, y completado el análisis estructural (Cuadro 5a) y las relaciones analógicas con el tópico para explicar los cambios de estado (Cuadro 5b).
A continuación, se presentan el resultado del análisis de cada uno de los sistemas considerados.
| Cuadro 1a. Presupuestos teóricos del tópico CINÉTICO-PARTICULAR: PRESUPUESTOS |
|---|
| Toda la materia está formada por partículas y entre ellas el espacio está vacío, es decir, entre ellas no hay nada. Son tan pequeñas que no pueden verse con el microscopio más potente. Son distintas para cada sustancia pura, diferenciándose en masa y volumen. |
| Las partículas están en continuo movimiento intrínseco, llamado agitación térmica. Puede ser de traslación, de rotación y vibración. El movimiento tiende a desordenar las partículas y es responsable de la disgregación de la materia. Es decir, cuanto mayor es el movimiento de las partículas su desorden es mayor. |
| La temperatura está relacionada con el movimiento intrínseco de las partículas. Cuanto mayor es la temperatura mayor es el movimiento de las partículas. |
| Las partículas están sujetas a interacciones o fuerzas de cohesión con otras. Pueden ser fuertes, débiles y extremadamente débiles, prácticamente inexistentes. Las fuerzas de cohesión tienden a ordenar las partículas en determinadas posiciones. Es decir, cuanto mayor son las fuerzas entre las partículas el orden de estas es mayor. |
| La disposición de las partículas en sólidos, líquidos y gases es el resultado de su movimiento y de las interacciones. |
| El movimiento en los gases (movimiento de traslación, rotación y vibración) es de mayor intensidad que en los líquidos (traslación, rotación y vibración) y mucho menor en los sólidos (sólo vibración). |
| Las fuerzas de cohesión en los sólidos son fuertes, mucho mayores que en los líquidos, que son débiles, y prácticamente inexistentes en los gases. |
| En el caso de los gases las partículas están bastante alejadas en comparación con su tamaño. La distancia media aproximada entre partículas, en condiciones normales, es diez veces el tamaño de la partícula. En el caso de líquidos y sólidos la distancia entre partículas es similar y mucho menor que en los gases, aproximadamente igual de grande que el tamaño de una partícula. |
| En los gases las partículas no ocupan posiciones fijas, están desordenadas y se mueven al azar vibrando, rotando y trasladándose en todas direcciones. En los líquidos las partículas tampoco ocupan posiciones fijas, están desordenadas, aunque menos que los gases, y se mueven al azar, igual que en los gases, pero con menor intensidad. En los sólidos las partículas ocupan posiciones fijas, están ordenadas y no tienen movimiento de traslación ni rotación, sólo vibración. |
| Cuadro 1b. Análisis estructural del tópico CINÉTICO-PARTICULAR: ANÁLISIS |
|---|
| Sistema. Es el objeto de estudio: |
Materia, sustancia pura, sólido, líquido y gas |
| Componentes. Son los elementos que configuran el sistema: |
| Partículas |
| Atributos (Son propiedades o características de los componentes o del sistema): |
|
• Toda la materia está formada por partículas. • Entre las partículas el espacio está vacío, es decir, entre ellas no hay nada. • Las partículas son tan pequeñas que no pueden verse con el microscopio más potente. • Las partículas son distintas para cada sustancia pura, diferenciándose en su masa y volumen. • Las partículas están en continuo movimiento intrínseco, llamado agitación térmica. • Las partículas están sujetas a interacciones o fuerzas de cohesión con otras. |
| Nexos.Son relaciones entre los componentes y sus atributos: |
|
• El movimiento puede ser de traslación, de rotación y vibración. • El movimiento tiende a desordenar las partículas y es responsable de la disgregación de la materia. Es decir, cuanto mayor es el movimiento de las partículas el desorden es mayor. • La temperatura está relacionada con el movimiento intrínseco de las partículas. Cuanto mayor es la temperatura mayor es el movimiento de las partículas. • Las fuerzas de cohesión entre partículas pueden ser fuertes, débiles y extremadamente débiles, prácticamente inexistentes. • Las fuerzas de cohesión tienden a ordenar las partículas en determinadas posiciones. Es decir, cuanto mayor son las fuerzas entre las partículas el orden de estas es mayor. • La disposición –posición, orden y distancia- de las partículas en sólidos, líquidos y gases es el resultado de su movimiento y de las interacciones. • El movimiento en los gases (movimiento de traslación, rotación y vibración) es de mayor intensidad que en los líquidos (traslación, rotación y vibración) y mucho menor en los sólidos (sólo vibración). • Las fuerzas de cohesión en los sólidos son fuertes, mucho mayores que en los líquidos, que son débiles, y prácticamente inexistentes en los gases. • En el caso de los gases, las partículas están bastante alejadas en comparación con su tamaño. La distancia media aproximada entre partículas, en condiciones normales, es diez veces el tamaño de la partícula. • En el caso de líquidos y sólidos, la distancia entre partículas es similar y mucho menor que en los gases, aproximadamente igual de grande que el tamaño de una partícula. • En los gases las partículas no ocupan posiciones fijas, están desordenadas y se mueven al azar vibrando, rotando y trasladándose en todas direcciones. • En los líquidos las partículas no ocupan posiciones fijas, están desordenadas, aunque menos que en los gases, y se mueven al azar, igual que en los gases, pero con menor intensidad. • En los sólidos las partículas ocupan posiciones fijas, están ordenadas y no tienen movimiento de traslación ni rotación, sólo vibración. |
| Cuadro 2a. Análisis estructural del análogo del estado sólido BATALLÓN MILITAR |
|---|
 Journal Chemical Education, vol. 70, nº 1, pg. 56 |
| Sistema. Es el objeto de estudio: |
|
Batallón militar en formación. |
| Componentes. Son los elementos que configuran el sistema: |
|
Soldados |
| Atributos. Son propiedades o características de los componentes o del sistema: |
|
• Todos los batallones militares están formados por soldados. • Entre soldado y soldado, en formación, no hay nadie. • Los soldados son personas de tamaño grande. • Los soldados tienen masa y volumen, es decir, ocupan un espacio. • Todos los soldados de un batallón llevan el mismo uniforme. • Los soldados están obligados a permanecer en formación y saludar. • Los soldados, sin romper la formación, pueden moverse. |
| Nexos.Son relaciones entre los componentes y sus atributos: |
|
• Los soldados en formación ocupan posiciones fijas y están ordenados en filas. • Los soldados en formación sólo se balancean, no pueden desplazarse ni girar. • La obligación de los soldados de permanecer en formación es muy grande. • La distancia entre soldados es pequeña, aproximadamente igual a su anchura. • La distancia entre soldado y soldado en formación es igual. |
| Cuadro 2b. Trama analógica para el estado sólido | ||
|---|---|---|
| ANÁLOGO | TÓPICO | |
|
Sistema Es el objeto de estudio |
Batallón militar en formación | Materia: estado sólido |
|
Componentes Son los elementos que configuran el sistema |
Personas: soldados | Partículas |
|
Atributos Son propiedades o características de los componentes o del sistema |
Todos los batallones militares están formados por soldados. | Todos los sólidos están formados por partículas. |
| Entre soldado y soldado, en formación, no hay nadie. | Entre las partículas el espacio está vacío. | |
| Los soldados son personas de tamaño grande. | Las partículas son tan pequeñas que no pueden verse. | |
| Los soldados tienen masa y ocupan un espacio. | Las partículas tienen masa y ocupan un espacio. | |
| Todos los soldados de un batallón llevan el mismo uniforme. | Todas las partículas de una sustancia puras son iguales. | |
| Los soldados, sin romper la formación, pueden moverse. | Las partículas están en continuo movimiento intrínseco, llamado agitación térmica. | |
| Los soldados están obligados a permanecer en formación y saludar. | Las partículas están sujetas a interacciones o fuerzas de cohesión con otras. | |
|
Nexos Son relaciones entre los componentes y sus atributos |
Los soldados en formación ocupan posiciones fijas y están ordenados en filas. | En los sólidos las partículas ocupan posiciones fijas y están ordenadas. |
| Los soldados en formación sólo se balancean, no pueden desplazarse ni girar. | El movimiento en los sólidos es sólo de vibración, no se trasladan ni rotan. | |
| La distancia entre soldados es pequeña, aproximadamente igual a su anchura. | La distancia entre partículas es muy pequeña, aproximadamente igual su tamaño. | |
| La distancia entre soldado y soldado en formación es igual. | La distancia entre partículas en el sólido es igual. | |
| La obligación de los soldados de permanecer en formación es muy grande. | Las fuerzas de cohesión entre las partículas en los sólidos son fuertes. | |
| LIMITACIONES Precisan diferencias en las relaciones entre tópico y análogo |
• Al contrario que las partículas de una sustancia pura, los soldados de un batallón no son iguales ni tienen la misma masa y volumen. • Entre los soldados existe aire; la ausencia de soldados representa el vacío. • Aunque puedan oscilar, los soldados deben estar quietos; el sistema no representa el movimiento continuo de las partículas. • En el batallón no existe un efecto similar al de la temperatura sobre el movimiento de las partículas; aunque, el cansancio podría tener efecto sobre el movimiento y relacionarse con la temperatura. • Al contrario que las partículas de una sustancia pura, que están distribuidas en tres dimensiones, los soldados en formación se distribuyen en dos dimensiones. |
|
| Cuadro 3a. Análisis estructural del análogo del estado líquido FIESTA |
|---|
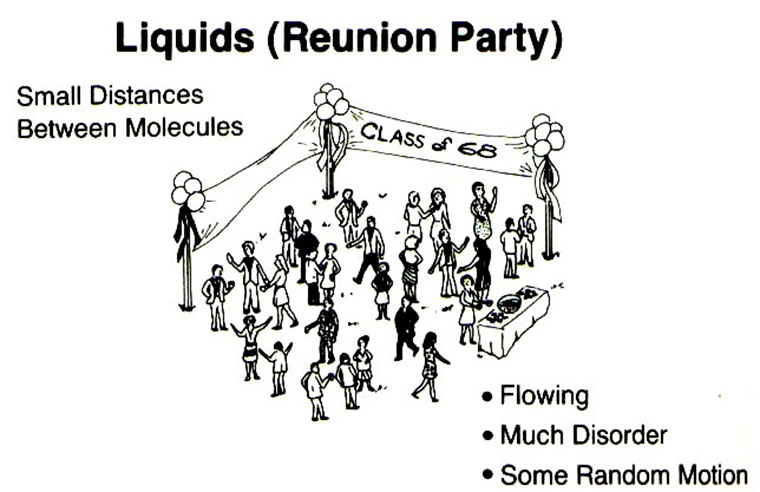 Figura 5. J.C.E., vol. 70, nº 1, pág. 56 |
| Sistema. Es el objeto de estudio: |
|
Celebración de una fiesta. |
| Componentes. Son los elementos que configuran el sistema: |
|
Personas: amigas o conocidas. |
| Atributos. Son propiedades o características de los componentes o del sistema: |
|
• A una celebración acuden personas amigas o conocidas. • Todas las personas son diferentes: hombres, mujeres, adolescentes, niños... • Las personas tienen masa y volumen. • Las personas tienen diferentes tamaños: altos, bajos, delgados… • Los personas en la fiesta interaccionan: se buscan, saludan, hablan, tocan… • Las personas pueden moverse dentro de la fiesta. |
| Nexos.Son relaciones entre los componentes y sus atributos: |
|
• La distancia entre las personas, aunque variable, suele ser pequeña. • Las personas se mueven de diferente manera: andan, giran y balancean. • Las personas en la fiesta pueden moverse en todas direcciones. • Las personas al moverse van cambiando su posición dentro de la sala de fiesta. • Las personas no ocupan posiciones fijas durante la fiesta. • Las personas se encuentran con cierto desorden dentro de la fiesta. |
| Cuadro 3b. Trama analógica para el estado líquido | ||
|---|---|---|
| ANÁLOGO | TÓPICO | |
|
Sistema Es el objeto de estudio |
Celebración de una fiesta | Materia: estado líquido |
|
Componentes Son los elementos que configuran el sistema |
Personas amigas o conocidas | Partículas |
|
Atributos Son propiedades o características de los componentes o del sistema |
A una celebración acuden personas amigas o conocidas. | Todos los líquidos están formados por partículas. |
| Todas las personas son diferentes: hombres, mujeres, adolescentes, niños... | Las partículas son distintas para cada sustancia pura. | |
| Las personas tienen diferentes tamaños: altos, bajos, delgados... | Las partículas son iguales en una misma sustancia pura y son tan pequeñas que no pueden verse. | |
| Las personas tienen masas y volumen. | Las partículas tienen masa y volumen. | |
| Las personas en la fiesta interaccionan: se buscan, saludan, hablan, tocan... | Las partículas están sujetas a interacciones o fuerzas de cohesión con otras. | |
| Las personas pueden moverse dentro de la fiesta . | Las partículas están en continuo movimiento intrínseco, llamado agitación térmica. | |
|
Nexos Son relaciones entre los componentes y sus atributos |
La distancia entre las personas, aunque variable, suele ser pequeña. | En el caso de los líquidos, la distancia entre partículas es similar, aproximadamente igual de grande que el tamaño de una partícula. |
| Las personas se mueven de diferente manera: andan, giran y balancean. | El movimiento de las partículas puede ser de traslación, rotación y vibración. | |
| Las personas en la fiesta se pueden mover en todas direcciones. | El movimiento de las partículas puede ser de traslación, rotación y vibración. | |
| Las personas al moverse van cambiando de posición dentro de la fiesta. | El movimiento de las partículas tiende a desordenarlas y es responsable de la disgregación de la materia. | |
| Las personas no ocupan posiciones fijas durante la fiesta. | En los líquidos las partículas no ocupan posiciones fijas, están desordenadas. | |
| Las personas se encuentran con cierto desorden dentro de la fiesta. | En los líquidos las partículas no ocupan posiciones fijas, están desordenadas . | |
| Limitaciones (Son relaciones entre los componentes y sus atributos): |
• Al contrario que las partículas de una sustancia pura, las personas que asisten a la fiesta no son iguales. • A diferencia de las partículas en el estado líquido, la distancia entre dos personas es variable y desigual. • No existe entre las personas la obligación de permanecer en la fiesta próximas entre sí, a diferencia de las partículas como consecuencia de las fuerzas de cohesión. • El movimiento de las personas no varía por ninguna causa directa, mientras que el de las partículas sí: lo hacen por el efecto de la temperatura. |
|
| Cuadro 4a. Análisis estructural del análogo del estado gaseoso PARTIDO DE FÚTBOL |
|---|
 Journal Chemical Education, vol. 70, nº 1, pg. 56 |
| Sistema. Es el objeto de estudio: |
|
Partido de fútbol. |
| Componentes. Son los elementos que configuran el sistema: |
|
Personas: futbolistas. |
| Atributos. Son propiedades o características de los componentes o del sistema: |
|
• Un partido se disputa entre futbolistas de dos equipos. • Los jugadores de un mismo equipo llevan igual vestimenta (camiseta, pantalones...), menos el portero. • Los futbolistas tienen masa y volumen; ocupan un espacio en el campo. • Durante el partido, los futbolistas interaccionan: pasan balón, se desmarcan, chocan entre sí…, siguen una táctica de juego. • Los jugadores se mueven continuamente dentro del campo. |
| Nexos.Son relaciones entre los componentes y sus atributos: |
|
• Los futbolistas pueden moverse de diferente forma: andan, corren, giran, saltan, driblan... • Los jugadores pueden moverse en todas direcciones por el campo. • Los jugadores van cambiando su posición durante el partido. • La posición de los jugadores en el campo parece desordenada. • La distancia entre dos jugadores es variable, desde muy juntos hasta muy separados. • Para la mayoría de los jugadores, la separación entre ellos es muy superior a su tamaño. |
| Cuadro 4b. Trama analógica para el estado gaseoso | ||
|---|---|---|
| ANÁLOGO | TÓPICO | |
|
Sistema Es el objeto de estudio |
Partido de fútbol | Materia: estado líquido |
|
Componentes Son los elementos que configuran el sistema |
Jugadores o futbolistas | Partículas |
|
Atributos Son propiedades o características de los componentes o del sistema |
Un partido se disputa entre futbolistas de dos equipos. | Todos los gases están formados por partículas. |
| Los jugadores de un mismo equipo llevan igual vestimenta (camiseta, pantalones…), menos el portero. | Las partículas son distintas para cada sustancia pura. | |
| Los futbolistas tienen masa y volumen; ocupan un espacio en el campo. | Las partículas tienen masa y volumen. | |
| Durante el partido, los futbolistas interaccionan: pasan balón, se desmarcan, chocan entre sí…, siguen una táctica de juego. | Las partículas establecen interacciones o fuerzas de cohesión con otras. | |
| Los jugadores se mueven continuamente dentro del campo. | Las partículas están en continuo movimiento intrínseco, llamado agitación térmica. | |
|
Nexos Son relaciones entre los componentes y sus atributos |
Los futbolistas pueden moverse de diferente forma: andan, corren, giran, saltan, driblan... | El movimiento de las partículas puede ser de traslación, rotación y vibración. |
| Los jugadores pueden moverse en todas direcciones por el campo. | El movimiento de las partículas puede ser de traslación, en todas direcciones. | |
| Los jugadores van cambiando su posición durante el partido. | En los gases las partículas no ocupan posiciones fijas, están desordenadas. | |
| La posición de los jugadores en el campo parece desordenada. | En los gases las partículas no ocupan posiciones fijas, están desordenadas y se mueven al azar en todas direcciones. | |
| La distancia entre dos jugadores es variable, desde muy juntos hasta muy separados. | En los gases las partículas están bastante alejadas en comparación con su tamaño. La distancia media aproximada entre partículas, en condiciones normales, es diez veces el tamaño de la partícula. | |
| Para la mayoría de los jugadores, la separación entre ellos es muy superior a su tamaño. | En los gases las partículas están bastante alejadas en comparación con su tamaño. La distancia media aproximada entre partículas, en condiciones normales, es diez veces el tamaño de la partícula. | |
| LIMITACIONES Precisan diferencias en las relaciones entre tópico y análogo |
• Al contrario que en las partículas de una sustancia pura, los jugadores en el campo pertenecen a dos equipos diferentes. Además, entre ellos tampoco son iguales. • Al contrario que en las partículas de un gas, la interacción entre jugadores es muy grande: corren tras la pelota, chocan, se empujan, defienden o atacan juntos... • A diferencia de las partículas del gas, que se mueven al azar, el movimiento de los jugadores varía por diferentes causas: la proximidad del balón, la posibilidad de gol, el estilo de cada futbolista, el cansancio... |
|
| Cuadro 5a. Análisis estructural del análogo de los cambios de estado CLASE DE EDUCACIÓN FÍSICA |
|---|
| Sistema. Es el objeto de estudio: |
|
Clase de Educación Física: pista de deportes donde se realizan diferentes actividades (tabla de gimnasia, aeróbic y patinaje libre) |
| Componentes. Son los elementos que configuran el sistema: |
|
Personas: futbolistas. |
| Atributos. Son propiedades o características de los componentes o del sistema: |
|
• La clase está formada por un número determinado de alumnos y un profesor. • Entre alumno y alumno no hay nadie. Existe aire por tanto no hay vacío . • Los alumnos tienen un tamaño grande y visible. • Los alumnos de una clase son del mismo curso, aunque diferentes entre si: chicos, chicas, edad, altura, peso… • Los alumnos tienen masa y volumen, es decir, ocupan un espacio . • Los alumnos pueden moverse dentro de la pista del pabellón. • Los alumnos modifican su movimiento con el ritmo de la música que suena . • Los alumnos interaccionan entre si: hablan, tocan, miran... y deben seguir las indicaciones del profesor. |
| Nexos.Son relaciones entre los componentes y sus atributos: |
|
• Los alumnos pueden moverse balanceándose, girando, saltando y trasladándose. • El movimiento de los alumnos aumenta el desorden y hace que se vayan dispersando por el pabellón. • El ritmo de la música hace que los alumnos se muevan de diferente forma y rapidez. A mayor ritmo mayor movimiento. • Las indicaciones del profesor pueden tener mayor o menor firmeza. Puede dar muchas instrucciones para realizar la actividad y exigir que los alumnos las sigan (máxima disciplina) hasta dar muy pocas y dejar que actúen los alumnos (mínima disciplina). La realización de cada actividad requiere un número de instrucciones diferentes, muchas para realizar conjuntamente la tabla de gimnasia o pocas para que los alumnos patinen libremente. • Las indicaciones del profesor tienden a mantener a los alumnos con cierto orden, ocupando determinadas posiciones en el pabellón.: cuanto mayor es la firmeza de las instrucciones del profesor los alumnos se mantienen más ordenados. • La posición, orden y distancia de los alumnos durante la clase es el resultado de su mayor o menor movimiento (ritmo de la música) y de las instrucciones del profesor (tipo de actividad). • El movimiento de los alumnos durante la actividad de patinaje es de mayor intensidad que durante el aeróbic y mucho mayor que durante la gimnasia. • La actividad de gimnasia requiere mayores instrucciones que la de aerobic y prácticamente ninguna el patinaje. • En el patinaje los alumnos suelen estar bastante alejados en comparación con su tamaño. En general, la distancia entre ellos es varias veces su tamaño. • En aeróbic y gimnasia los alumnos suelen estar a una distancia similar y mucho menor que en el patinaje. La separación es aproximadamente igual a la longitud de sus brazos estirados. • En patinaje los alumnos se distribuyen por toda la pista del pabellón sin ocupar posiciones fijas y moviéndose en todas direcciones trasladándose, girando, saltando y balanceándose. • En aeróbic los alumnos pueden modificar sus posiciones haciendo balanceos, giros, saltos y desplazamientos, aunque de menor intensidad que en el patinaje. • En gimnasia los alumnos ocupan posiciones fijas, mantienen un orden y no se trasladan ni realizan rotaciones, sólo mueven partes de su cuerpo (brazos y piernas) se balancean y saltan. |
| Cuadro 5b. Trama analógica para los cambios de estado de agregación | ||
|---|---|---|
| ANÁLOGO | TÓPICO | |
|
Sistema Es el objeto de estudio |
Clase de Educación Física: pista de deportes donde se realizan diferentes actividades (tabla de gimnasia, aeróbic y patinaje libre). | Materia: materia, sustancia pura, sólido, líquido y gas. |
|
Componentes Son los elementos que configuran el sistema |
Alumnos, Profesor | Partículas |
|
Atributos Son propiedades o características de los componentes o del sistema |
La clase está formada por un número determinado de personas: muchos alumnos y un profesor. | Todos los gases están formados por partículas. |
| Entre alumno y alumno no hay nadie, existe aire, por tanto no hay vacío. | Entre las partículas el espacio está vacío, es decir, entre ellas no hay nada. | |
| Los alumnos tienen un tamaño grande y visible. | Las partículas son tan pequeñas que no pueden verse con el microscopio más potente. | |
| Los alumnos de una clase son del mismo curso, aunque diferentes entre si: chicos, chicas, edad, altura, peso… | Las partículas de una sustancia pura son todas iguales y diferentes a las de otra sustancia pura. | |
| Los alumnos tienen masa y volumen, es decir, ocupan un espacio. | Las partículas tienen masa y volumen, es decir, aunque muy pequeñas ocupan un espacio. | |
| Los alumnos pueden moverse dentro de la pista del pabellón y modifican su movimiento con el ritmo de la música que suena. | Las partículas están en continuo movimiento intrínseco, llamado agitación térmica. | |
| Los alumnos interaccionan entre si: hablan, tocan, miran... y deben seguir las indicaciones del profesor. | Las partículas establecen interacciones o fuerzas de cohesión con otras. | |
|
Nexos Son relaciones entre los componentes y sus atributos |
Los alumnos pueden moverse balanceándose, girando, saltando y trasladándose. | El movimiento puede ser de traslación, de rotación y vibración. |
| El movimiento de los alumnos aumenta el desorden y hace que se vayan dispersando por el pabellón. | El movimiento tiende a desordenar las partículas y es responsable de la disgregación de la materia. Es decir, cuanto mayor es el movimiento de las partículas el desorden es mayor.. | |
| El ritmo de la música hace que los alumnos se muevan de diferente forma y rapidez. A mayor ritmo mayor movimiento. | La temperatura está relacionada con el movimiento intrínseco de las partículas. Cuanto mayor es la temperatura mayor es el movimiento de las partículas. | |
| Las indicaciones del profesor pueden tener mayor o menor firmeza. Puede dar muchas instrucciones para realizar la actividad y exigir que los alumnos las sigan (máxima disciplina) hasta dar muy pocas y dejar que actúen los alumnos (mínima disciplina). La realización de cada actividad requiere un número de instrucciones diferentes, muchas para realizar conjuntamente la tabla de gimnasia o pocas para que los alumnos patinen libremente. | Las fuerzas de cohesión entre partículas pueden ser fuertes, débiles y extremadamente débiles, prácticamente inexistentes. | |
| Las indicaciones del profesor tienden a mantener a los alumnos con cierto orden, ocupando determinadas posiciones en el pabellón. Cuanto mayor es la firmeza de las instrucciones del profesor los alumnos se mantienen más ordenados. | Las fuerzas de cohesión tienden a ordenar las partículas en determinadas posiciones. Es decir, cuanto mayor son las fuerzas entre las partículas el orden de éstas es mayor. | |
| La posición, orden y distancia de los alumnos durante la clase es el resultado de su mayor o menor movimiento (ritmo de la música) y de las instrucciones del profesor (tipo de actividad). | La disposición –posición, orden y distancia- de las partículas en sólidos, líquidos y gases es el resultado del movimiento y de las interacciones. | |
| El movimiento de los alumnos durante la actividad de patinaje es de mayor intensidad que durante el aeróbic y mucho mayor que durante la gimnasia. | El movimiento en los gases (movimiento de traslación, rotación y vibración) es de mayor intensidad que en los líquidos (traslación, rotación y vibración) y mucho menor en los sólidos (sólo vibración). | |
| La actividad de gimnasia requiere mayores instrucciones que la de aeróbic y prácticamente ninguna el patinaje. | Las fuerzas de cohesión en los sólidos son fuertes, mucho mayores que en los líquidos, que son débiles, y prácticamente inexistentes en los gases. | |
| En el patinaje los alumnos suelen estar bastante alejados en comparación con su tamaño. En general, la distancia entre ellos es varias veces su tamaño. | En el caso de los gases las partículas están bastante alejadas en comparación con su tamaño. La distancia media aproximada entre partículas, en condiciones normales, es diez veces el tamaño de la partícula. | |
| En aeróbic y gimnasia los alumnos suelen estar a una distancia similar y mucho menor que en el patinaje. La separación es aproximadamente igual a la longitud de sus brazos estirados. | En el caso de líquidos y sólidos la distancia entre partículas es similar y mucho menor que en los gases, aproximadamente igual de grande que el tamaño de una partícula. | |
| En patinaje los alumnos se distribuyen por toda la pista del pabellón sin ocupar posiciones fijas y moviéndose en todas direcciones trasladándose, girando, saltando y balanceándose. | En los gases las partículas no ocupan posiciones fijas, están desordenadas y se mueven al azar vibrando, rotando y trasladándose en todas direcciones. | |
| En aeróbic los alumnos pueden modificar sus posiciones haciendo balanceos, giros, saltos y desplazamientos, aunque de menor intensidad que en el patinaje. | En los líquidos las partículas no ocupan posiciones fijas, están desordenadas, aunque menos que los gases, y se mueven al azar, igual que en los gases, pero con menor intensidad. | |
| En gimnasia los alumnos ocupan posiciones fijas, mantienen un orden y no se trasladan ni realizan rotaciones, sólo mueven partes de su cuerpo (brazos y piernas) se balancean y saltan. | En los sólidos las partículas ocupan posiciones fijas, están ordenadas y no tienen movimiento de traslación ni rotación sólo vibración. | |
| Limitaciones (Son relaciones entre los componentes y sus atributos): |
• El profesor, que forma parte de la clase, es un componente sin correspondencia en el MCP. • Los alumnos ocupan un espacio pero también el aire que existe entre ellos. • Los alumnos son grandes y visibles, al contrario que las partículas. • La identidad de los alumnos de una clase no es la misma, al contrario que las partículas en una sustancia pura. • El movimiento de los alumnos, en todas las actividades, ocurre en un espacio bidimensional. • El movimiento de los alumnos, en cualquier caso, no es al azar sino responde a las reglas de cada actividad (gimnasia, aeróbic, patinaje) mediadas por las indicaciones del profesor. |
|
